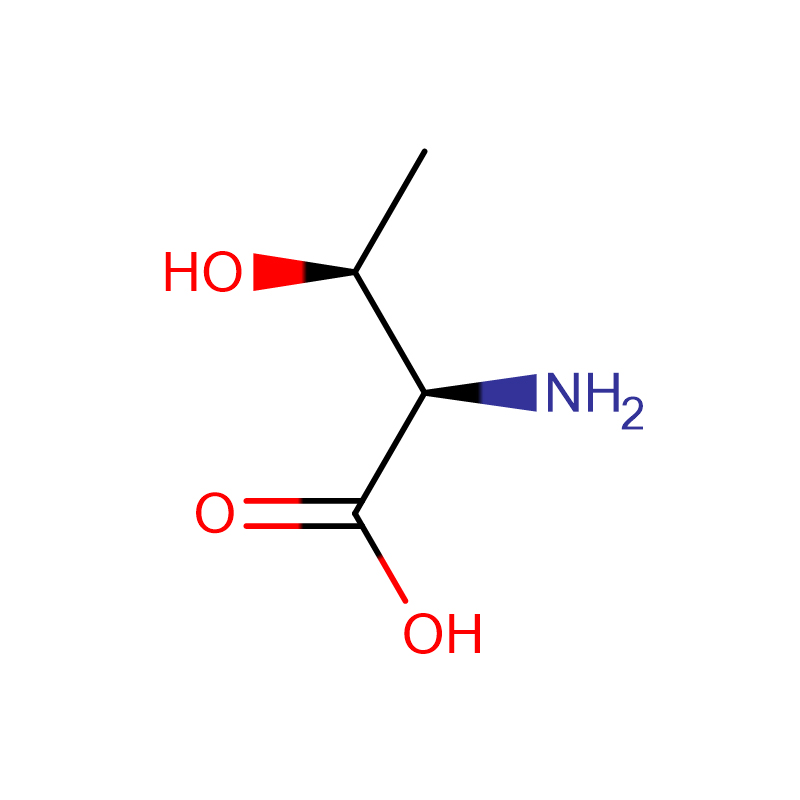
L-Proline Cas: 147-85-3 99% თეთრი ფხვნილი
| კატალოგის ნომერი | XD90293 |
| Პროდუქტის სახელი | ლ-პროლინი |
| CAS | 147-85-3 |
| Მოლეკულური ფორმულა | C5H9NO2 |
| Მოლეკულური წონა | 115.13046 |
| შენახვის დეტალები | ამბიენტური |
| ჰარმონიზებული სატარიფო კოდექსი | 29339980 |
პროდუქტის სპეციფიკაცია
| ანალიზი | 99% წთ |
| გარეგნობა | თეთრი ფხვნილი |
| სპეციფიკური როტაცია | -84,5-დან -86-მდე |
| Მძიმე მეტალები | <15ppm |
| AS | <1ppm |
| Ph | 5.9 - 6.9 |
| SO4 | <0.050% |
| Fe | <30ppm |
| ზარალი გაშრობისას | <0.3% |
| ნარჩენი ანთებაზე | <0.10% |
| NH4 | <0.02% |
| Cl | <0.050% |
| გადაწყვეტის მდგომარეობა | >98% |
მიკრობული მასპინძლის მეტაბოლიზმის გააზრება აუცილებელია მთლიან უჯრედებზე დაფუძნებული ბიოკატალიტიკური პროცესების განვითარებისა და ოპტიმიზაციისთვის, რადგან ის კარნახობს წარმოების ეფექტურობას.ეს განსაკუთრებით ეხება რედოქს ბიოკატალიზს, სადაც მეტაბოლურად აქტიური უჯრედები გამოიყენება მასპინძელში ენდოგენური კოფაქტორის/კოსსუბსტრატის რეგენერაციული შესაძლებლობების გამო.რეკომბინანტული Escherichia coli გამოიყენებოდა პროლინ-4-ჰიდროქსილაზას (P4H) ზედმეტად წარმოქმნისთვის, დიოქსიგენაზა, რომელიც აკატალიზებს თავისუფალი L-პროლინის ჰიდროქსილაციას ტრანს-4-ჰიდროქსი-L-პროლინად ა-კეტოგლუტარატთან (a-KG), როგორც კოსუბსტრატი.ამ მთლიანუჯრედოვან ბიოკატალიზატორში, ცენტრალური ნახშირბადის მეტაბოლიზმი უზრუნველყოფს აუცილებელ კოსსუბსტრატს a-KG, აკავშირებს P4H ბიოკატალიზურ მოქმედებას პირდაპირ ნახშირბადის მეტაბოლიზმთან და მეტაბოლურ აქტივობასთან.როგორც ექსპერიმენტული, ასევე გამოთვლითი ბიოლოგიის ინსტრუმენტების გამოყენებით, როგორიცაა მეტაბოლური ინჟინერია და (13)C-მეტაბოლური ნაკადის ანალიზი ((13)C-MFA), ჩვენ გამოვიკვლიეთ და რაოდენობრივად აღვწერეთ მთელი უჯრედის ბიოკატალიზატორის ფიზიოლოგიური, მეტაბოლური და ბიოენერგეტიკული პასუხი. მიზანმიმართული ბიოკონვერტაციისთვის და გამოვლინდა შესაძლო მეტაბოლური შეფერხებები შემდგომი რაციონალური გზის ინჟინერიისთვის. პროლინის დეგრადაციის დეფიციტი E. coli შტამი აშენდა putA გენის წაშლით, რომელიც აკოდირებს პროლინ დეჰიდროგენაზას.მთლიანი უჯრედის ბიოტრანსფორმაციამ ამ მუტანტის შტამით გამოიწვია არა მხოლოდ პროლინის რაოდენობრივი ჰიდროქსილირება, არამედ ტრანს-4-L-ჰიდროქსიპროლინის (ჰიპ) წარმოქმნის სპეციფიკური სიჩქარის გაორმაგება ველურ ტიპთან შედარებით.ნახშირბადის ნაკადის ანალიზმა მუტანტის შტამის ცენტრალური მეტაბოლიზმის მეშვეობით გამოავლინა, რომ გაზრდილი a-KG მოთხოვნა P4H აქტივობაზე არ აძლიერებს a-KG წარმომქმნელ ნაკადს, რაც მიუთითებს მჭიდროდ რეგულირებულ TCA ციკლის მოქმედებაზე შესწავლილ პირობებში.ველური ტიპის შტამში, P4H სინთეზმა და კატალიზმა გამოიწვია ბიომასის მოსავლიანობის შემცირება.საინტერესოა, რომ ΔputA შტამი დამატებით ანაზღაურებდა ასოცირებულ ATP და NADH დანაკარგს შემანარჩუნებელი ენერგიის მოთხოვნილების შემცირებით გლუკოზის შეწოვის შედარებით დაბალი სიჩქარით, TCA აქტივობის გაზრდის ნაცვლად. იყოს პერსპექტიული P4H პროდუქტიული კატალიზისთვის არა მხოლოდ ბიოტრანსფორმაციის გამოსავლიანობის თვალსაზრისით, არამედ ბიოტრანსფორმაციისა და პროლინის ათვისების სიჩქარის და ენერგიის წყაროზე ჰიპ-ის ეფექტურობის თვალსაზრისით.შედეგები მიუთითებს, რომ putA ნოკაუტის შემდეგ, TCA-ციკლის დაწყვილება პროლინის ჰიდროქსილირებასთან a-KG კოსუბსტრატის მეშვეობით ხდება ძირითადი შემაკავებელი ფაქტორი და სამიზნე a-KG-დამოკიდებული ბიოტრანსფორმაციების ეფექტურობის შემდგომი გასაუმჯობესებლად.